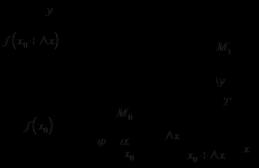Низшие алкены (С 2 - С 5), в промышленных масштабах получают из газов, образующихся при термической переработке нефти и нефтепродуктов. Алкены можно также получить, используя лабораторные методы синтеза.
4.5.1. Дегидрогалогенирование
При обработке галогеналканов основаниями в безводных растворителях, например, спиртовым раствором едкого кали, происходит отщепление галогеноводорода.
4.5.2. Дегидратация
При нагревании спиртов с серной или фосфорной кислотами происходит внутримолекулярная дегидратация (b- элиминирование).
Преобладающее направление реакции, как и в случае дегидрогалогенирования, - образование наиболее устойчивого алкена (правило Зайцева).
Дегидратацию спиртов можно провести, пропуская пары спирта над катализатором (оксиды алюминия или тория) при 300 - 350 о С.
4.5.3. Дегалогенирование вицинальных дигалогенидов
Действием цинка в спирте дибромиды, содержащие галогены у соседних атомов (вицинальные), могут быть превращены в алкены.

Гидрирование алкинов
При гидрировании алкинов в присутствии платинового или никелевого катализаторов, активность которых уменьшена добавлением небольшого количества соединений свинца (каталитический яд), образуется алкен, который не подвергается дальнейшему восстановлению.
Восстановительное сочетание альдегидов и кетонов
При обработке алюмогидридом лития и хлоридом титана(III) из двух молекул альдегида или кетона с хорошими выходами образуются ди- или соответственно тетразамещённые алкены.

АЛКИНЫ
Алкинами называются углеводороды, содержащие тройную углерод-углеродную связь –СºС–.
Общая формула простых алкинов С n H 2n-2 . Простейшим представителем класса алкинов является ацетилен H–СºС–H, поэтому алкины называют также ацетиленовыми углеводородами.
Строение ацетилена
Атомы углерода ацетилена находятся в sp -гибридном состоянии. Изобразим орбитальную конфигурацию такого атома. При гибридизации 2s -орбитали и 2р -орбитали образуются две равноценные sp -гибридные орбитали, расположенные на одной прямой, и остаются две негибридизованные р -орбитали.

Рис. 5.1 Схема формирования sp -гибридных орбиталей атома углерода
Направления и формы орбиталей sр -гибридизованного атома углерода: гибридизованные орбитали эквивалентны, максимально удалены друг от друга
В молекуле ацетилена простая связь (s- связь) между атомами углерода образована перекрыванием двух sp -гибридизованных орбиталей. Две взаимно перпендикулярные p- связи возникают при боковом перекрывании двух пар негибридизованных 2р- орбиталей, p- электронные облака охватывают скелет так, что электронное облако имеет симметрию, близкую к цилиндрической. Связи с атомами водорода образуются за счёт sp -гибридных орбиталей атома углерода и 1s -орбитали атома водорода, молекула ацетилена линейна.

Рис. 5.2 Молекула ацетилена
а - боковое перекрывание 2р орбиталей дает две p -связи;
б - молекула линейна, p -облако имеет цилиндрическую форму
В пропине простая связь (s- связь) С sp -С sp3 короче аналогичной связи С sp -С sp2 в алкенах, это объясняется тем, что sp- орбиталь ближе к ядру, чем sp 2 - орбиталь .
Тройная углерод-углеродная связь С º С короче двойной связи, а общая энергия тройной связи приблизительно равна сумме энергий одной простой связи С–С (347 кДж/моль) и двух p-связей (259·2 кДж/моль) (табл. 5.1).
В природе алкены встречаются редко. Методы получения алкенов можно разделить на промышленные и лабораторные.
A. Промышленные методы получения:
Обычно газообразные алкены (этилен, пропилен, бутен) выделяют из газов деструктивной переработки нефти (это термический, каталитический крекинг), реакции пиролиза, из газов коксования угля. В зависимости от видов сырья и условий, содержание алкенов может варьироваться от 15 до 55%.
1. Реакция дегидрирования алканов..
B. Лабораторные методы:
2.Частичное гидрирование ацетиленовых углеводородов

2. Отщепление галогеноводородов от галогеналкилов при действии на них спиртового раствора щелочи:
Правило Зайцева: при отщеплениигалогена атом водорода легче всего отщепляется от соседнего наименее гидрогенизированного атома углерода.

3. Дегидратация спиртов (отнятие воды).
Различают два вида дегидратации:
a)Сернокислотный способ H 2 SO 4 концент.
б) Каталитический способ, в присутствии Al 2 O 3 (при 350-400 0 С)

Легче в реакцию вступают третичные спирты, далее вторичные, и усложняется проведение реакции с первичными.
Химические свойства
В отличии от алканов алкены обладают значительной реакционной активностью, что определяются наличием двойной связи.
1. Галогенирование (присоединение галогенов). Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенпроизводных:

3. Гидрогалогенирование (присоединение галогенводородов)
![]()
Правило Марковникова :
В реакции присоединения галогенводорода к несимметричным алкенам в обычных условиях, водород присоединяется к наиболее гидрогенизированному атому углерода по месту двойной связи.

Правило объясняется с точки зрения электронной теории, либо теории устойчивости промежуточного карбкатиона
Отклонение в реакции гидрогалогенирования происходит в присутствии перекиси водорода Н 2 О 2 или кислорода. Порядок реакции меняется с ионного на радикальный и присоединение идет против реакции Марковникова, т.е. имеет обратный порядок. Такая реакция имеет свое название:
Гидрогалогенирование. Перекисный эффект Караша.

4. Гидратация – присоединение воды, протекает в присутствии серной кислоты, с образованием спиртов.
Окисление
а) окисление в мягких условиях – реакция Вагнера (разбавленный раствор КМnО 4 при н.у.)
б) жесткое окисление, протекает с разрывом σ- и π –связей, с образованием карбоновых кислот или кетонов.
Полимеризация

n - степень полимеризации, n = 100 – 10 000
ДИЕНЫ
Алкадиены – ациклические непредельные углеводороды, в молекулах которых помимо одинарных связей имеется две двойные связи между атомами углерода.
Общая формула алкадиенов С n H 2 n-2 .
Строение . В зависимости от взаимного расположения двойных связей различают три вида диенов:
· Алкадиены с куммулированным расположением двойных связей
· Алкадиены с сопряженными двойными связями
СH 2 =CH-CH=CH 2
· Алкадиены с изолированными двойными связями
CH 2 =CH-CH 2 -CH 2 -CH=CH 2
Методы получения .
1. Дегидрирование н-бутана (двухстадийный каталитический процесс).
Аналогичным способом получают изопрен (2-метилбутадиен-1,3).
2. Метод Лебедева. Получение бутадиена из этилового спирта, в данном методе протекают две реакции одновременно дегидратации и дегидрирования.
3. Дегидрогалогенирование.
При действии на дибромалканы спиртового раствора щелочи происходит отщепление двух молекул галогеноводорода и образование двух двойных связей.

Химические свойства.
Свойства алкадиенов с изолированными двойными связями мало отличаются от обычных алкенов. Мы остановимся на диенах с сопряженными связями, которые обладают некоторыми особенностями.
А. Реакции присоединения . Диены способны присоединять водород, галогены, галогеноводороды. Особенностью присоединения к диенам является способность присоединять молекулы как в положение 1,2- так и в положение 1,4-.
1. Гидрирование.
2. Галогенирование.

3. Гидрогалогенирование.

Б.Реакции полимеризации .
Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Реакция эта является основой для получения синтетических каучуков.

Тема урока: Алкены. Получение, химические свойства и применение алкенов.
Цели и задачи урока:
- рассмотреть конкретные химические свойства этилена и общие свойства алкенов;
- углубить и конкретизировать понятия о?-связи, о механизмах химических реакций;
- дать первоначальные представления о реакциях полимеризации и строении полимеров;
- разобрать лабораторные и общие промышленные способы получения алкенов;
- продолжить формирование умения работать с учебником.
Оборудование: прибор для получения газов, раствор КМnO 4 , этиловый спирт, концентрированная серная кислота, спички, спиртовка, песок, таблицы «Строение молекулы этилена», «Основные химические свойства алкенов», демонстрационные образцы «Полимеры».
ХОД УРОКА
I. Организационный момент
Мы продолжаем изучение гомологического ряда алкенов. Сегодня нам предстоит рассмотреть способы получения, химические свойства и применение алкенов. Мы должны охарактеризовать химические свойства, обусловленные двойной связью, получить первоначальные представления о реакциях полимеризации, рассмотреть лабораторные и промышленные способы получения алкенов.
II. Активизация знаний учащихся
- Какие углеводороды называются алкенами?
- Каковы особенности их строения?
- В каком гибридном состоянии находятся атомы углерода, образующие двойную связь в молекуле алкена?
Итог: алкены отличаются от алканов наличием в молекулах одной двойной связи, которая обуславливает особенности химических свойств алкенов, способов их получения и применения.
III. Изучение нового материала
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C 8 H 18 ––> C
4 H
8
+ C 4 H 10 ; (термический крекинг при 400-700 o С)
октан
бутен
бутан
– дегидрирование алканов C 4 H 10 ––> C 4 H 8
+ H 2 ; (t, Ni)
бутан
бутен
водород
– дегидрогалогенирование галогеналканов C 4 H 9 Cl
+ KOH ––> C 4 H 8 + KCl
+ H 2 O;
хлорбутан
гидроксид бутен
хлорид
вода
калия
калия
– дегидрогалогенирование дигалогеналканов 
– дегидратация спиртов С 2 Н 5 ОН ––> С 2 Н 4
+ Н 2 О (при нагревании в присутствии
концентрированной серной кислоты)
Запомните!
При реакиях
дегидрирования, дегидратации,
дегидрогалогенирования и дегалогенирования
нужно помнить, что водород преимущественно
отрывается от менее гидрогенизированных атомов
углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов
Характер углерод – углеродной связи
определяет тип химических реакций, в которые
вступают органические вещества. Наличие в
молекулах этиленовых углеводородов двойной
углерод – углеродной связи обуславливает
следующие особенности этих соединений:
– наличие двойной связи позволяет отнести
алкены к ненасыщенным соединениям. Превращение
их в насыщенные возможно только в результате
реакций присоединения, что является основной
чертой химического поведения олефинов;
– двойная связь представляет собой значительную
концентрацию электронной плотности, поэтому
реакции присоединения носят электрофильный
характер;
– двойная связь состоит из одной - и одной -связи, которая достаточно легко
поляризуется.
Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.

Запомни! Возможны следующие механизмы разрыва -связи:
а) если алкены и реагент – неполярные соединения, то -связь разрывается с образованием свободного радикала:
H 2 C = CH 2 + H: H ––> + +
б) если алкен и реагент – полярные соединения, то разрыв -связи приводит к образование ионов:
в) при соединении по месту разрыва -связи реагентов, содержащих в составе молекулы атомы водорода, водород всегда присоединяется к более гидрированному атому углерода (правило Морковникова, 1869 г.).
– реакция полимеризации nCH 2 = CH 2
––> n – CH 2 – CH 2 –– > (– CH 2 – CH 2
–)n
этен
полиэтилен
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства (инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной
серной кислоты, 1 мл спирта и небольшое
количество песка.
2. Закройте пробирку пробкой с газоотводной
трубкой и нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с
перманганатом калия. Обратите внимание на
изменение цвета раствора.
4. Подожгите газ у конца газоотводной трубки.
Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C 2 H 4 + 3O 2 ––> 2CO 2 + 2H 2 O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
CH 3 – CH = CH 2 + 4 [O] ––> CH 3 COOH + HCOOH
– каталичесикое окисление
Запомните главное!
1. Непредельные углеводороды активно вступают в
реакции присоединения.
2. Реакционная активность алкенов связана с тем,
что - связь под
действием реагентов легко разрывается.
3. В результате присоединения происходит переход
атомов углерода из sp 2 – в sp 3 -
гибридное состояние. Продукт реакции имеет
предельный характер.
4. При нагревании этилена, пропилена и других
алкенов под давление или в присутствии
катализатора их отдельные молекулы соединяются
в длинные цепочки – полимеры. Полимеры
(полиэтилен, полипропилен) имеют большое
практическое значение.
3. Применение алкенов (сообщение учащегося по следующему плану).
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.
III. Закрепление изученного материала

Домашнее задание: §§ 15, 16, упр. 1, 2, 3 стр. 90, упр. 4, 5 стр. 95.
Алкины, галогенопроизводные, спирты, полимеры и другие. Главная проблема ненасыщенных углеводородов - почти полное отсутствие их в природе, по большей части вещества конкретно этого ряда добывают в лаборатории путем химического синтеза. Для того чтобы понять особенности реакций получения алкенов, нужно разобраться в их строении.
Что такое алкены?
Алкены - органические вещества, которые состоят из атомов углерода и водорода. Особенностью этого ряда являются двойные ковалентные связи: сигма и пи. Они обуславливают химические и физические свойства веществ. Температура плавления у них ниже, чем у соответствующих алканов. Также от этого "базового" ряда углеводородов алкены отличаются наличием реакции присоединения, которая происходит путем разрыва пи-связи. Для них характерны четыре вида изомерии:
- по положению двойной связи;
- по изменениям углеродного скелета;
- межклассовая (с циклоалканами);
- геометрическая (цис- и транс-).
Другое название этого ряда веществ - олефины. Это обусловлено их схожестью с многоатомными карбоновыми кислотами, которые в своем составе имеют двойную связь. Номенклатура алкенов отличается тем, что определение первого атома в карбоновой цепи ведется по размещению кратной связи, положение которой также указывается в названии вещества.
Крекинг - основной способ добывания алкенов
Крекинг - вид переработки нефти при высоких температурных режимах. Главная цель этого процесса - добывание веществ с меньшей молекулярной массой. Крекинг для получения алкенов происходит во время расщепления алканов, которые входят в состав нефтепродуктов. Это происходит при температурах от 400 до 700 °С. В ходе этой реакции получения алкенов, помимо вещества, которое было целью ее проведения, образуется алкан. Общее количество атомов углерода до и после реакции - одинаковое.

Другие промышленные способы получения алкенов
Нельзя продолжать разговор об алкенах без упоминания о реакции дегидрирования. Для ее проведения берется алкан, в котором может образоваться двойная связь после отщепления двух атомов водорода. То есть метан в эту реакцию вступать не будет. Поэтому ряд алкенов начитается с этилена. Особенными условиями к проведению реакции являются повышенная температура и катализатор. В роли последнего может выступать никель или оксид хрома (III). Результатом реакции будет получение алкена с соответствующим количеством атомов углерода и бесцветного газа (водорода).
Другим промышленным способом добывания веществ этого ряда является гидрирование алкинов. Эта реакция получения алкенов проходит при повышенных температурах и при участии катализатора (никеля или платины). Механизм гидрирования строится на разрывании одной из двух пи связей предоставленного алкина, после чего по местам разрушения присоединяются атомы водорода.

Лабораторный способ с использованием спирта
Одним из самых простых и не затратных способов является внутримолекулярная дегидратация, то есть отщепление воды. При написании уравнения реакции стоит помнить, что она будет осуществляться по правилу Зайцева: водород отщепится от наименее гидрированного атома углерода. Температура при этом должна быть выше 150 °С. В качестве катализатора нужно использовать вещества с гигроскопическими свойствами (способными натягивать влагу), например, серную кислоту. По месту отрыва гидроксильной группы и водорода будет образовываться двойная связь. Результатом реакции будут соответствующий алкен и одна молекула воды.

Добывание в лаборатории на основе галогенопроизводных
Существует еще два лабораторных способа. Первый - действие раствором щелочи на производные алканов, которые в свое составе имеют один атом галогена. Такой способ называют дегидрогалогенированием, то есть отщеплением соединений водорода с неметаллическими элементами седьмой группы (фтор, бром, хлор, йод). Осуществление механизма реакции, так же как и в предыдущем случае, проходит по правилу Зайцева. Катализирующим условиями являются спиртовой раствор и повышенная температура. После проведения реакции образуются алкен, соль металлического элемента щелочи и галогена, вода.
Второй способ очень напоминает предшествующий. Он осуществляется с помощью алкана, который имеет в составе два галогена. На такое вещество действуют активным металлом (цинком или магнием) в присутствии раствора спирта и повышенной температуры. Реакция будет проходить только в том случае, если водород замещен на галоген у двух соседних атомов углерода, если условие не соблюдено, то двойная связь не образуется.
Почему нужно брать именно цинк и магний? В ходе реакции происходит окисление металла, который может отдать два электрона, и отщепление двух галогенов. Если взять щелочные элементы, они будут реагировать с водой, которая есть в составе раствора спирта. Что же касается металлов, которые в ряду Бекетова стоят после магния и цинка, то они будут слишком слабыми.
В органической химии можно встретить углеводородные вещества с разным количеством углерода в цепи и C=C-связью. Они являются гомологами и называются алкенами. Из-за своего строения они химически более активны, чем алканы. Но какие именно реакции для них характерны? Рассмотрим их распространение в природе, разные способы получения и применение.
Что из себя представляют?
Алкены, которые также называются олефинами (маслянистые) получили свое название от этен-хлорида, производного первого представителя этой группы. У всех алкенов есть хотя бы одна двойная C=C-связь. C n H 2n - формула всех олефинов, а название образовывается от алкана с таким же количеством углеродов в молекуле, только суффикс -ан меняется на -ен. Арабской цифрой в конце названия через дефис обозначают номер углерода, от которого начинается двойная связь. Рассмотрим основные алкены, таблица поможет вам запомнить их:
Если молекулы имеют простое неразветвленное строение, то добавляют суффикс -илен, это также отражено в таблице.
Где их можно встретить?
Так как реакционная способность алкенов весьма высока, их представители в природе встречаются крайне редко. Принцип жизни молекулы олефинов — "давай дружить". Нет вокруг других веществ — не беда, будем дружить между собой, образуя полимеры.
Но они есть, и небольшое количество представителей входит в состав сопутствующего нефтяного газа, а высших — в нефти, добываемой на территории Канады.
Самый первый представитель алкенов этен — это гормон, стимулирующий созревание плодов, поэтому его в небольших количествах синтезируют представители флоры. Есть алкен цис-9-трикозен, который у самок мухи домашней играет роль полового аттрактанта. Еще его называют мускалур. (Аттрактант — вещества природного или синтетического происхождения, которое вызывает влечение к источнику запаха у другого организма). С точки зрения химии, алкен этот выглядит так:
Так как весьма ценным сырьем являются все алкены, способы получения их искусственным путем весьма разнообразны. Рассмотрим наиболее распространенные.
А если нужно много?
В промышленности класс алкенов, в основном, получается при крекинге, т.е. расщеплении молекулы под воздействием высоких температур, высших алканов. Для реакции необходим нагрев в диапазоне от 400 до 700 °C. Расщепляется алкан так, как ему захочется, образуя алкены, способы получения которых мы рассматриваем, с большим количеством вариантов строения молекул:
C 7 H 16 -> CH 3 -CH=CH 2 + C 4 H 10.
Еще один распространенный способ называется дегидрирование, при котором от представителя ряда алкана в присутствии катализатора отделяют молекулу водорода.
В лабораторных условиях алкены и способы получения отличаются, они основаны на реакциях элиминирования (отщепления группы атомов без их замещения). Чаще всего элиминируются атомы воды из спиртов, галогены, водород или галогенводород. Наиболее распространенный способ получения алкенов — из спиртов в присутствии кислоты, как катализатора. Возможно использование и других катализаторов
Все реакции элиминирования подчинены правилу Зайцева, гласящему:
Атом водорода отщепляется от того углерода, соседствующего с углеродом, несущим группу -OH, у которого меньше водородов.

Применив правило, ответьте, какой продукт реакции будет преобладать? Позже вы узнаете, правильно ли ответили.
Химические свойства
Алкены активно реагируют с веществами, разрывая свою пи-связь (еще одно название связи C=C). Ведь она не такая прочная, как одинарная (сигма-связь). Углеводород из ненасыщенного превращается в насыщенный, не образуя других веществ после реакции (присоединение).
- присоединение водорода (гидрирование). Присутствие катализатора и нагревания нужна для ее прохождения;
- присоединение молекул галогенов (галогенирование). Является одной из качественных реакций на пи-связь. Ведь при реакции алкенов с бромной водой, она из бурой становится прозрачной;
- реакция с галогенводородами (гидрогалогенирование);
- присоединение воды (гидратация). Условиями прохождения реакции является нагревание и присутствие катализатора (кислоты);
Реакции несимметричных олефинов с галогенводородами и водой подчиняются правилу Марковникова. А значит, водород присоединится к тому углероду из двойной углерод-углеродной связи, у которого уже больше атомов водорода.

- горение;
- неполное окисление каталитическое. Продуктом являются циклические оксиды;
- реакция Вагнера (окисление перманганатом в нейтральной среде). Эта реакция алкенов — еще одна качественная C=C-связь. При протекании розовый раствор марганцовки обесцвечивается. Если ту же реакцию провести в соединенной кислой среде, продукты будут уже другими (карбоновые кислоты, кетоны, углекислый газ);
- изомеризация. Характерны все виды: цис- и транс-, перемещение двойной связи, циклизация, скелетная изомеризация;
- полимеризация — главное свойство олефинов для промышленности.
Применение в медицине
Большое практическое значение имеют продукты реакции алкенов. Многие из них используются в медицине. Из пропена получают глицерин. Этот многоатомный спирт является прекрасным растворителем, причем, если его использовать вместо воды, растворы будут более концентрированными. В медицинских целях в нем растворяют алкалоиды, тимол, йод, бром и др. Также глицерин применяют при приготовлении мазей, паст и кремов. Он предотвращает их высыхание. Сам по себе глицерин является антисептиком.
При реакции с хлороводородом получаются производные, которые применяются как местная анестезия при нанесении на кожу, а также для кратковременного наркоза при незначительных хирургических вмешательствах, при помощи ингаляций.

Алкадиены — это алкены с двумя двойными связями в одной молекуле. Основное их применение — производство синтетического каучука, из которого потом изготавливают различные грелки и спринцовки, зонды и катетеры, перчатки, соски и многое другое, что просто незаменимо при уходе за больными.
Применение в промышленности
| Вид промышленности | Что применяют | Каким образом могут использовать |
| Сельское хозяйство | этен | ускоряет созревание овощей и фруктов, дефолиация растений, пленки для теплиц |
| Лако-красочная | этен, бутен, пропен и др. | для получения растворителей, эфиров, сольвента |
| Машиностроение | 2-метилпропен, этен | производство синтетического каучука, смазочные масла, антифриз |
| Пищевая промышленность | этен | производство тефлона, этилового спирт, уксусная кислота |
| Химическая промышленность | этен, полипропилен | получают спирты, полимеры (поливинилхлорид, полиэтилен, поливинилацетат, полиизобтилен, уксусный альдегид |
| Горная промышленность | этен и др. | взрывчатые вещества |
Более широкое применение нашли алкены и их производные в промышленности. (Где и как используются алкены, таблица выше).

Это лишь малая часть использования алкенов и их производных. С каждым годом потребность в олефинах только возрастает, а значит, возрастает потребность и в их производстве.