Пусть жидкость находится в каком-либо сосуде. Если расстояния между поверхностями, ограничивающими жидкость сравнимы с радиусом кривизны поверхности жидкости, то такие сосуды называются капиллярами . Явления, происходящие в капиллярах, называются капиллярными явлениями . К капиллярным явлениям относят капиллярный подъём жидкости и капиллярное сцепление между смачиваемыми поверхностями.
Наиболее простыми и часто используемыми капиллярами являются цилиндрические капилляры (рис.10.10). Поверхность жидкости в таких капиллярах является сферической. Пусть r - радиус кривизны поверхности жидкости, R – радиус капилляра, θ – краевой угол. В случае частичного смачивания жидкость будет подниматься по капилляру под действием давления Лапласа, до тех пор, пока его не скомпенсирует гидравлическое давление жидкости:
Где ρ – плотность жидкости, g – ускорение силы тяжести, h – высота капиллярного подъёма. Радиус кривизны поверхности жидкости удобно выразить через радиус капилляра, который можно легко измерить: . Подставляя давление Лапласа для сферической поверхности выражение (10-12), получим:
В случае полного смачивания θ =0 о, cos θ =1 , r = R и формула высоты капиллярного подъёма имеет вид:
При полном несмачивании θ=180 о, cos θ = - 1, и высота капиллярного подъёма будет отрицательной, то есть поверхность жидкости опустится на величину h (рис. 10.11).
Интересно отметить, что в сообщающихся капиллярах высота уровня жидкости не одинакова. Наибольший капиллярный подъём наблюдается в самом узком капилляре, а наименьший – в самом широком капилляре (рис.10.12).
Для полного смачивания . Капиллярные явления наблюдаются при подъёме воды к поверхности почвы, при использовании промокательной бумаги, тряпки, при подъёме керосина в фитилях и т.п.
С повышением температуры коэффициент поверхностного натяжения жидкостей уменьшается, а при критической температуре равен нулю. Коэффициент поверхностного натяжения жидкостей зависит также от плотности и молярной массы жидкости. Причём зависимость коэффициента поверхностного натяжения от температуры выражена тем сильнее, чем больше плотность жидкости и меньше её молярная масса. Для определения коэффициента поверхностного натяжения можно использовать полуэмпирическую формулу:
Здесь В – постоянный коэффициент, практически одинаковый для всех жидкостей, Т к – критическая температура, ρ- плотность жидкости, μ – её молярная масса, τ- небольшая величина размерности температуры. Формула (10-14) неприменима вблизи критической температуры. Коэффициент поверхностного натяжения водных растворов зависит от рода растворённого вещества. Одни вещества, например, такие как спирт, мыло, стиральные порошки, растворённые в воде, имеющие меньшую, чем у воды плотность, приводят к уменьшению коэффициента поверхностного натяжения и называются поверхностно активными веществами . Поверхностно активные вещества применяют в качестве смачивателей, флотационных реагентов, пенообразователей, диспергаторов- понизителей твёрдости, пластифицирующих добавок, модификаторов кристаллизации и т.п. Увеличение концентрации таких веществ приводит к уменьшению коэффициента поверхностного натяжения. Другие вещества, растворённые в воде, например, сахар, соль, приводят к увеличению плотности раствора и увеличивают коэффициент поверхностного натяжения. Увеличение концентрации таких веществ приводит к увеличению коэффициента поверхностного натяжения. Для экспериментального определения коэффициентов поверхностного натяжения используют несколько методов измерения: метод Ребиндера, метод капиллярных волн, метод капли и пузырька и др.
При смачивании возникает искривление поверхности, изменяющее свойства поверхностного слоя. Существование избытка свободной энергии у искривленной поверхности приводит к так называемым капиллярным явлениям - весьма своеобразным и важным.
Проведем сначала качественное рассмотрение на примере мыльного пузыря. Если мы в процессе выдувания пузыря откроем конец трубочки, то увидим, что пузырь, находящийся на ее конце, будет уменьшатся в размерах и втянется в трубку. Поскольку воздух с открытого конца сообщался с атмосферой, постольку для поддержания равновесного состояния мыльного пузыря необходимо чтобы давление внутри было больше, чем внешнее. Если при этом соединить трубочку с монометром, то на нем регистрируется некоторая разность уровней - избыточное давление DР в объемной фазе газа с вогнутой стороны поверхности пузыря.
Установим количественную зависимость между DР и радиусом кривизны поверхности 1/r между двумя объемными фазами, находящимися в состоянии равновесия и разделенными сферической поверхностью. (например пузырек газа в жидкости или капля жидкости в фазе пара). Для этого используем общее термодинамическое выражение для свободной энергии при условии Т = const и отсутствии переноса вещества из одной фазы в другую dn i = 0. В состоянии равновесия возможны вариации поверхности ds и объема dV. Пусть V увеличится на dV, а s - на ds. Тогда:
dF = - P 1 dV 1 - P 2 dV 2 + sds.
В состоянии равновесия dF = 0. С учетом того, что dV 1 = dV 2 , находим:
P 1 - P 2 = s ds/dV.
Т.о P 1 > P 2 . Учитывая, что V 1 = 4/3 p r 3 , где r - радиус кривизны, получаем:
Подстановка дает уравнение Лапласа:
P 1 - P 2 = 2s/r. (1)
В более общем случае для элипссоида вращения с главными радиусами кривизны r 1 и r 2 , закон Лапласа формулируется:
P 1 - P 2 = s/(1/R 1 - 1/R 2).
При r 1 = r 2 получаем (1), при r 1 = r 2 = ¥ (плоскость) P 1 = P 2 .
Разность DР называют капиллярным давлением. Рассмотрим физический смысл и следствия из закона Лапласа, являющегося основой теорий капиллярных явлений.Уравнение показывает, что разность давлений в объемных фазах возрастает с увеличением s и с уменьшением радиуса кривизны. Таким образом, чем выше дисперсность, тем больше внутренее давление жидкости со сферической поверхностью. Например для капли воды в фазе пара при r = 10 -5 см, DР = 2 . 73 . 10 5 дин/см 2 »15 ат. Таким образом давление внутри капли по сравнению с паром оказывается на 15 ат выше, чем в фазе пара. Необходимо помнить, что независимо от агрегатного состояния фаз, в состоянии равновесия давление с вогнутой стороны поверхности всегда больше, чем с выпуклой.Уранение дает основу для экспериментального измерения s методом наибольшего давления пузырьков. Одно из важнейших следствий существования капиллярного давления - поднятие жидкости в капилляре.
Капиллярные явления наблюдаются в содержащих жидкость
В узких сосудах, у которых расстояние между стенками соизмеримо с радиусом кривизны поверхности жидкости. Кривизна возникает в результате взаимодействия жидкости со стенками сосуда. Специфика поведения жидкости в капиллярных сосудах зависит от того, смачивает или несмачивает жидкость стенки сосуда, точнее от значения краевого угла смачивания.
Рассмотрим положение уровней жидкостей в двух капиллярах, один из которых имеет лиофильную поверхность и поэтому стенки его смачиваются, а у другого поверхность лиофобизирована и не смачивается. В первом капилляре поверхность имеет отрицательную кривизну. Дополнительное давление Лапласа стремится растянуть жидкость. (давление направлено к центру кривизны). Давление под поверхъностью понижено по сравнению с давлением у плоской поверхности. В результате возникает выталкивающая сила, поднимающая жидкость в капилляре до тех пор, пока вес столба не уравновесит действующую силу.Во втором капилляре кривизна поверхности положительная, дополнительное давление направлено внутрь жидкости, в результате жидкость в капилляре опускается.
При равновесии лапласовское давление равно гидростатическому давлению столба жидкости высотой h:
DР = ± 2s/r = (r - r o) gh, где r , r o - плотности жидкости и газовой фазы, g- ускорение свободного падения, r -радиус мениска.
Чтобы высоту капиллярного поднятия связать с характеристикой смачивания, радиус мениска выразим через угол смачивания Q и радиус капилляра r 0. Понятно, что r 0 = r cosQ, высота капиллярного поднятия выразится ввиде (формула Жюрена):
h = 2sсosQ / r 0 (r - r 0)g
При отсутствии смачивания Q>90 0 , сosQ < 0, уровень жидкости опускается на величину h. При полном смачивании Q = 0, сosQ = 1, в этом случае радиус мениска равен радиусу капилляра. Измерение высоты капиллярного поднятия лежит в основе одного из наиболее точных методов определения поверхностного натяжения жидкостей.
Капиллярным поднятием жидкостей объясняется ряд известных явлений и процессов: пропитка бумаги, тканей обусловлена капиллярным поднятием жидкости в порах. Водонепроницаемость тканей обеспечивается их гидрофобностью - следствие отрицательного капиллярного поднятия. Подъем воды из почвы, происходит благодаря структуре почвы и обеспечивает существование растительного покрова Земли, подъем воды из почвы по стволам растений происходит благодаря волокнистому строению древесины, процесс кровообращения в кровеносных сосудах, поднятие влаги в стенах здания (прокладывают гидроизоляцию) и т д.
Термодинамическая реакционная способность (т.р.с.).
Характеризует способность вещества переходить в какое-либо иное состояние, например в другую фазу, вступать в химическую реакцию. Она указывает на удаленность данной системы от состояния равновесия при данных условиях. Т.р.с. определяется химическим сродством, которое можно выразить изменением энергии Гиббса или разностью химических потенциалов.
Р.с зависит от степени дисперсности вещества. Изменение степени дисперсности может приводить к сдвигу фазового или химического равновесия.
Соответствующее приращение энергии Гиббса dG д (из-за изменения дисперсности) можно представить в виде объединенного уравнения первого и второго начала термодинамики: dG д = -S dT + V dp
Для индивидуального вещества V =V мол и при Т = const имеем: dG д = V мол dp или DG д = V мол Dp
Подставляя в это уравнение соотношение Лапласа, получим dG д = s V мол ds/dV
для сферической кривизны: dG д =±2 s V мол /r (3)
Уравнения показывают, что приращение реакционной способности, обусловленное изменением дисперсности, пропорционально кривизне поверхности, или дисперсности.
Если рассматривается переход вещества из конденсированной фазы в газообразную, то энергию Гиббса можно выразить через давление пара, приняв его за идеальный. Тогда дополнительное изменение энергии Гиббса, свзанное с изменением дисперсности состовляет:
dG д = RT ln (p д / p s) (4), где p д и p s - давление насыщенного пара над искривленной и ровной поверхностями.
Подставляя (4) в (3) получим: ln (p д / p s) = ±2 s V мол /RТ r
Cоотношение носит название уравнения Кельвина - Томсона. Из этого уравнения следует, что при положительной кривизне давление насыщенного пара над искривленной поверхностью будет тем больше, чем больше кривизна, т.е. меньше радиус капли. Например для капли воды с радиусом r = 10 -5 см (s=73, V мол =18) p д / p s = 0,01, т.е.1%. Это следствие из закона Кельвина - Томсона позволяет предсказать явление изотремической перегонки, заключающейся в испарении наиболее малых капель и конденсации пара на более крупных каплях и на плоской поверхности.
При отрицательной кривизне, имеющей место в капиллярах при смачивании, получается обратная зависимость: давление насыщенного пара над искривленной поверхностью (над каплей) уменьшается с увеличением кривизны (с уменьшением радиуса капилляра). Т.о, если жидкость смачивает капилляр, то конденсация паров в капилляре происходит при меньшем давлении, чем на ровной поверхности. Именно поэтому уравнени Кельвина часто называют уравнением капиллярной конденсации.
Рассмотрим влияние дисперсности частиц на их растворимость. Учитывая, что изменение энергии Гиббса выражается через растворимость вещества в разном дисперсном состоянии аналогично соотношению (4), получим для неэлектролитов:
ln(c д /c a) = ±2 s V мол /RТ r где c д и c a - растворимость вещества в высокодисперсном состоянии и растворимость при равновесии с крупными частицами этого вещества
Для электролита, диссоциируюшего в растворе на n ионов, можно записать (пренебрегая коэффициентами активности):
ln(a д /a с) = n ln (c д /c s) = ±2 s V мол /RТ r , где a д и a с - активности электролита в растворах, насыщенных по отношению к в высокодисперсном у и грубодисперсному состоянию. Уравнения показывают, что с увеличением дисперсности растворимость растет, или химический потенциал частиц дисперсной системы больше, чем у крупной частицы, на величину 2 s V мол /r. В то же время растворимость зависит от знака кривизны поверхности, а это значит, что если частицы твердого вещества имеют неправильную форму с положительной и отрицательной кривизной и находятся в насыщенном растворе, то участки с положительной кривизной будут растворяться, а с отрицательной - наращиваться. В результате частицы растворяемого вещества со временем приобретают вполне определенную форму, отвечающую равновесному состоянию.
Степень дисперсности может также влиять на равновесие химической реакции: - DG 0 д = RT ln (К д / К), где DG 0 д - приращение химического сродства, обусловленное дисперсностью, К д и К - константы равновесия реакций с участием диспергированных и недиспергированных веществ.
С увеличением дисперсности повышается активность компонентов, а в соответствии с этим изменяется константа химического равновесия в ту или другую сторону, в зависимости от степени дисперсности исходных веществ и продуктов реакции. Например для реакции разложения карбоната кальция: CaCO 3 « CaO + CO 2
повышение дисперсности исходного карбоната кальция сдвигает равновесие в правую сторону, и давление диоксида углерода над системой возрастает. Увеличение дисперсности оксида кальция приводит к противоположному результату.
По той же причине с увеличением дисперсности ослабляется связь кристаллизационной воды с веществом. Так макрокристалл Al 2 O 3 . 3 Н 2 О отдает воду при 473 К, в то время как в осадке из частиц коллоидных размеров кристаллогидрат разлагается при 373 К. Золото не взаимодейтсвует с хлороводородной кислотой, а коллоидное золото в ней растворяется. Грубодисперсная сера не взаимодействует заметно с солями серебра, а коллоидная сера образует сульфид серебра.
Внимание! Администрация сайта сайт не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
- Участник:Николаев Владимир Сергеевич
- Руководитель:Сулейманова Альфия Сайфулловна
Введение
В наш век высоких технологий все большее значение в жизни людей имеют естественные науки. Люди 21 века производят супер производительные компьютеры,смартфоны,все глубже и глубже изучают окружающий нас мир. Я думаю, что люди готовятся к новой научно технической революции, которая изменит наше будущее коренным образом. Но когда произойдут эти изменения никто не знает. Каждый человек своим трудом может приблизить этот день.
Эта научно-исследовательская работа – мой маленький вклад в развитие физики.
Данная научно-исследовательская работа посвящена актуальной на данный момент теме «Капиллярные явления». В жизни мы часто имеем дело с телами, пронизанными множеством мелких каналов (бумага, пряжа, кожа, различные строительные материалы, почва, дерево). Приходя в соприкосновение с водой или другими жидкостями, такие тела очень часто впитывают их в себя. В данном проекте показана важность капилляров в жизни живых и неживых организмов.
Цель исследовательской работы: обосновать с точки зрения физики причину движения жидкости по капиллярам, выявить особенности капиллярных явлений.
Объект исследования: свойство жидкостей, всасываясь, подниматься или опускаться по капиллярам.
Предмет исследования: капиллярные явления в живой и неживой природе.
- Изучить теоретический материал о свойствах жидкости.
- Ознакомиться с материалом о капиллярных явлениях.
- Провести серию экспериментов с целью выяснения причины поднятия жидкости в капиллярах.
- Обобщить изученный в ходе работы материал и сформулировать вывод.
Прежде чем перейти к изучению капиллярных явлений, надо ознакомиться со свойствами жидкости, которые играют немалую роль в капиллярных явлениях.
Поверхностное натяжение
Сам термин «поверхностное натяжение» подразумевает, что вещество у поверхности находится в «натянутом», то есть напряжённом состоянии, которое объясняется действием силы, называемой внутренним давлением. Она стягивает молекулы внутрь жидкости в направлении, перпендикулярном её поверхности. Так, молекулы, находящиеся во внутренних слоях вещества, испытывают в среднем одинаковое по всем направлениям притяжение со стороны окружающих молекул; молекулы же поверхностного слоя подвергаются неодинаковому притяжению со стороны внутренних слоёв веществ и со стороны, граничащей с поверхностным слоем среды. Например, на поверхности раздела жидкость – воздух молекулы жидкости, находящиеся в поверхностном слое, сильнее притягиваются со стороны соседних молекул внутренних слоёв жидкости, чем со стороны молекул воздуха. Это и является причиной различия свойств поверхностного слоя жидкости от свойств её внутренних объёмов.
Внутреннее давление обуславливает втягивание молекул, расположенных на поверхности жидкости, внутрь и тем самым стремится уменьшить поверхность до минимальной при данных условиях. Сила, действующая на единицу длины границы раздела, обуславливающая сокращение поверхности жидкости, называется силой поверхностного натяжения или просто поверхностным натяжением σ .
Поверхностное натяжение различных жидкостей неодинаково, оно зависит от их мольного объёма, полярности молекул, способности молекул к образованию водородной связи между собой и др.
При увеличении температуры поверхностное натяжение уменьшается по линейному закону. На поверхностное натяжение жидкости оказывают влияние и находящиеся в ней примеси. Вещества, ослабляющие поверхностное натяжение, называют поверхностно-активными (ПАВ). По отношению к воде ПАВ являются нефтепродукты, спирты, эфир, мыло и др. жидкие и твёрдые вещества. Некоторые вещества увеличивают поверхностное натяжение. Примеси солей и сахара, например.
Объяснение этому даёт МКТ. Если силы притяжения между молекулами самой жидкости больше сил притяжения между молекулами ПАВ и жидкости, то молекулы жидкости уходят внутрь из поверхностного слоя, а молекулы ПАВ вытесняются на поверхность. Очевидно, что молекулы соли и сахара будут втянуты в жидкость, а молекулы воды вытеснены на поверхность. Таким образом, поверхностное натяжение – основное понятие физики и химии поверхностных явлений – представляет собой одну из наиболее важных характеристик и в практическом отношении. Следует отметить, что всякое серьёзное научное исследование в области физики гетерогенных систем требует измерения поверхностного натяжения. История экспериментальных методов определения поверхностного натяжения, насчитывающая более двух столетий, прошла путь от простых и грубых способов до прецизионных методик, позволяющих находить поверхностное натяжение с точностью до сотых долей процента. Интерес к этой проблеме особенно возрос в последние десятилетия в связи с выходом человека в космос, развитием промышленного строения, где капиллярные силы в различных устройствах часто играют определяющую роль.
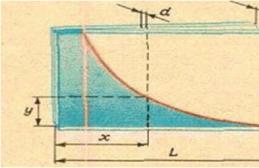
Один из таких методов определения поверхностного натяжения основан на поднятии смачивающей жидкости между двумя стеклянными пластинками. Их следует опустить в сосуд с водой и постепенно сближать параллельно друг другу. Вода начнёт подниматься между пластинками – её будет втягивать сила поверхностного натяжения, о которой сказано выше. Легко рассчитать коэффициент поверхностного натяжения σ можно по высоте подъёма воды у и зазору между пластинками d .
Сила поверхностного натяжения F = 2σ L , где L – длина пластинки (двойка появилась из-за того, что вода соприкасается с обеими пластинками). Эта сила удерживает слой воды массы m = ρ Ldу , где ρ – плотность воды. Таким образом, 2σ L = ρ Ldуg . Отсюда можно найти коэффициент поверхностного натяжения σ = 1/2(ρ gdу ). (1)Но интереснее сделать так: с одного конца сжать пластинки вместе, а с другого оставить небольшой зазор.

Вода поднимется и образует между пластинками удивительно правильную поверхность. Сечение этой поверхности вертикальной плоскостью – гипербола. Для доказательства достаточно в формулу (1) вместо d подставить новое выражение для зазора в данном месте. Из подобия соответствующих треугольников (см. рис. 2) d = D (x /L ). Здесь D – зазор на конце, L – по-прежнему длина пластинки, а x – расстояние от места соприкосновения пластинок до места, где определяется зазор и высота уровня. Таким образом, σ = 1/2(ρ gу )D (x /L ), или у = 2σ L/ρ gD(1/х ). (2)Уравнение (2) действительно является уравнением гиперболы.
Смачивание и несмачивание
Для детального изучения капиллярных явлений следует рассмотреть и некоторые молекулярные явления, обнаруживающиеся на трёхфазной границе сосуществования твёрдой, жидкой, газообразной фаз, в частности рассматривается соприкосновение жидкости с твёрдым телом. Если силы сцепления между молекулами жидкости больше, чем между молекулами твёрдого тела, то жидкость стремится уменьшить границу (площадь) своего соприкосновения с твёрдым телом, по возможности отступая от него. Капля такой жидкости на горизонтальной поверхности твёрдого тела примет форму сплюснутого шара. В этом случае жидкость называется несмачивающей твёрдое тело. Угол θ , образованный поверхностью твёрдого тела и касательной к поверхности жидкости, называется краевым. Для несмачивающей θ > 90°. В этом случае твёрдая поверхность, несмачиваемая жидкостью называется гидрофобной, или олоефильной. Если же силы сцепления между молекулами жидкости меньше, чем между молекулами жидкости и твёрдого тела, то жидкость стремится увеличить границу соприкосновения с твёрдым телом. В этом случае жидкость называется смачивающей твёрдое тело; краевой угол θ < 90°. Поверхность же будет носить название гидрофильная. Случай, когда θ = 180°, называется полным несмачиванием. Однако это практически никогда не наблюдается, так как между молекулами жидкости и твёрдого тела всегда действуют силы притяжения. При θ = 0° наблюдается полное смачивание: жидкость растекается по всей поверхности твёрдого тела. Полное смачивание или полное несмачиваение являются крайними случаями. Между ними в зависимости от соотношения молекулярных сил промежуточное положение занимают переходные случаи неполного смачивания.
Смачиваемость и несмачиваемость – понятия относительные: жидкость,смачивающая одно твёрдое тело, может не смачивать другое тело. Например,вода смачивает стекло, но не смачивает парафин; ртуть не смачивает стекло, но смачивает медь.
Смачивание обычно трактуется как результат действия сил поверхностного натяжения. Пусть поверхностное натяжение на границе воздух – жидкость σ 1,2,на границе жидкость – твёрдое тело σ 1,3, на границе воздух – твёрдое тело σ 2,3.
На единицу длины периметра смачивания действуют три силы, численно равные σ 1,2, σ 2,3, σ 1,3, направленные по касательной к соответствующим границам раздела. В случае равновесия все силы должны уравновешивать друг друга. Силы σ 2,3 и σ 1,3 действуют в плоскости поверхности твёрдого тела, сила σ 1,2 направлена к поверхности под углом θ .
Условие равновесия межфазных поверхностей имеет следующий вид: σ 2,3 = σ 1,3 + σ 1,2cosθ или cosθ =(σ 2,3 − σ1 ,3)/σ 1,2
Величину cosθ принято называть смачиванием и обозначать буквой В.
Определённое влияние на смачивание оказывает состояние поверхности. Смачиваемость резко меняется уже при наличии мономолекулярного слоя углеводородов. Последние же всегда присутствуют в атмосфере в достаточных количествах. Определённое влияние на смачивание оказывает и микрорельеф поверхности. Однако до настоящего времени пока не выявлена единая закономерность влияния шероховатости любой поверхности на смачивание её любой жидкостью. Например уравнение Венцеля-Дерягина cosθ = x cosθ0 связывает краевые углы жидкости на шероховатой (θ ) и гладкой (θ 0) поверхностях с отношением х площади истинной поверхности шероховатого тела к её проекции на плоскость. Однако на практике это уравнение не всегда соблюдается. Так, согласно этому уравнению в случае смачивания (θ<90) шераховатость должна приводить к понижению краевого угла (т.е. к большей гидрофильности), а в случае θ > 90 – к его увеличению (т.е. к большей гидрофобности). Исходя из этого и даются, как правило, сведения о влиянии шероховатости на смачивание.
По мнению многих авторов, скорость растекания жидкости на шероховатой поверхности ниже вследствие того, что жидкость при растекании испытывает задерживающее влияние встречающихся бугорков (гребней) шероховатостей. Необходимо отметить, что именно скорость изменения диаметра пятна, образованного строго дозированной каплей жидкости, нанесённой на чистую поверхность материала, используется в качестве основной характеристики смачивания в капиллярах. Её величина зависит как от поверхностных явлений, так и от вязкости жидкости, её плотности, летучести.
Очевидно, что более вязкая жидкость с прочими одинаковыми свойствами дольше растекается по поверхности и следовательно медленнее протекает по капиллярному каналу.
Капиллярные явления
Капиллярные явления, совокупность явлений, обусловленных поверхностным натяжением на границе раздела несмешивающихся сред (в системах жидкость - жидкость, жидкость - газ или пар) при наличии искривления поверхности. Частный случай поверхностных явлений.
Изучив подробно силы, лежащих в основе капиллярных явлений, стоит перейти непосредственно к капиллярам. Так, опытным путём можно пронаблюдать, что смачивающая жидкость (например, вода в стеклянной трубке) поднимается по капилляру. При этом, чем меньше радиус капилляра, тем на большую высоту поднимается в ней жидкость. Жидкость, не смачивающая стенки капилляра (например, ртуть с стеклянной трубке), опускается ниже уровня жидкости в широком сосуде. Так почему же смачивающая жидкость поднимается по капилляру, а несмачивающая опускается?
Не трудно заметить, что непосредственно у стенок сосуда поверхность жидкости несколько искривлена. Если молекулы жидкости, соприкасающиеся со стенкой сосуда, взаимодействуют с молекулами твёрдого тела сильнее, чем между собой, в этом случае жидкость стремится увеличить площадь соприкосновения с твёрдым телом (смачивающая жидкость). При этом поверхность жидкости изгибается вниз и говорят, что она смачивает стенки сосуда, в котором находится. Если же молекулы жидкости взаимодействуют между собой сильнее, чем с молекулами стенок сосуда, то жидкость стремится сократить площадь соприкосновения с твёрдым телом, её поверхность искривляется вверх. В этом случае говорят о несмачивании жидкостью стенок сосуда.
В узких трубочках, диаметр которых составляет доли миллиметра, искривлённые края жидкости охватывают весь поверхностный слой, и вся поверхность жидкости в таких трубочках имеет вид, напоминающий полусферу. Это так называемый мениск. Он может быть вогнутым, что наблюдается в случае смачивания, и выпуклым при несмачивании. Радиус кривизны поверхности жидкости при этом того же порядка, что и радиус трубки. Явления смачивания и несмачивания в данном случае также характеризуется краевым углом θ между смоченной поверхностью капиллярной трубки и мениском в точках их соприкосновения.
Под вогнутым мениском смачивающей жидкости давление меньше, чем под плоской поверхностью. Поэтому жидкость в узкой трубке (капилляре) поднимается до тех пор, пока гидростатическое давление поднятой в капилляре жидкости на уровне плоской поверхности не скомпенсирует разность давлений. Под выпуклым мениском несмачивающей жидкости давление больше, чем под плоской поверхностью, и это ведёт к опусканию несмачивающей жидкости.
Наличие сил поверхностного натяжения и кривизны поверхности жидкости в капиллярной трубочке ответственно за дополнительное давление под искривленной поверхностью, называемое давлением Лапласа: ∆p = ± 2σ /R.
Знак капиллярного давления («плюс» или «минус») зависит от знака кривизны. Центр кривизны выпуклой поверхности находится внутри соответствующей фазы. Выпуклые поверхности имеют положительную кривизну, вогнутые – отрицательную.
Так, условие равновесия жидкости в капиллярной трубочке определяется равенством

p 0 = p 0 – (2σ /R ) + ρ gh (1)
где ρ – плотность жидкости, h – высота её поднятия в трубочке, p 0 – атмосферное давление.
Из данного выражения следует, что h = 2σ /ρ gR . (2)
Преобразуем полученную формулу, выразив радиус кривизны R мениска через радиус капиллярной трубочки r .
Из рис. 6.18 следует, что r = R cosθ . Подставляя (1) в (2), получаем: h = 2σ cosθ /ρ gr .
Полученная формула, определяющая высоту поднятия жидкости в капиллярной трубочке, носит название формулы Жюрена. Очевидно, что чем меньше радиус трубки, тем на большую высоту поднимается в ней жидкость. Кроме того, высота поднятия растёт с увеличением коэффициента поверхностного натяжения жидкости.
Подъём смачивающей жидкости по капилляру можно объяснить и по-другому. Как было сказано ранее, под действием сил поверхностного натяжения поверхность жидкости стремится сократиться. Вследствие этого поверхность вогнутого мениска стремится выпрямиться и сделаться плоской. При этом она тянет за собой частицы жидкости, лежащие под ней, и жидкость поднимается по капилляру вверх. Но поверхность жидкости в узкой трубке плоской оставаться не может, она должна иметь форму вогнутого мениска. Как только в новом положении данная поверхность примет форму мениска, она снова будет стремиться сократиться и т.д. В результате действия этих причин смачивающая жидкость и поднимается по капилляру. Поднятие прекратится, когда сила тяжести Fтяж поднятого столба жидкости, которая тянет поверхность вниз, уравновесит равнодействующую силу F сил поверхностного натяжения, направленных касательно к каждой точке поверхности.
По окружности соприкосновения поверхности жидкости со стенкой капилляра действует сила поверхностного натяжения, равная произведению коэффициента поверхностного натяжения на длину окружности: 2σπ r , где r – радиус капилляра.
Сила тяжести, действующая на поднятую жидкость,
F тяж = mg = ρ Vg = ρπ r ^2hg
где ρ – плотность жидкости; h – высота столба жидкости в капилляре; g – устроение силы тяжести.
Подъём жидкости прекращается, когда F тяж = F или ρπ r ^2hg = 2σπ r . Отсюда высота поднятия жидкости в капилляре h = 2σ /ρ gR .
В случае несмачивающей жидкости последняя, стремясь сократить свою поверхность, будет опускаться вниз, выталкивая жидкость из капилляра.
Выведенная формула применима и для несмачивающей жидкости. В этом случае h – высота опускания жидкости в капилляре.
Капиллярные явления в природе
Капиллярные явления также весьма распространены в природе и часто используются в практической деятельности человека. Дерево, бумага, кожа, кирпич и очень многие другие предметы, окружающие нас, имеют капилляры. За счет капилляров вода поднимается по стеблям растений и впитывается в полотенце, когда мы им вытираемся. Поднятие воды по мельчайшим отверстиям в куске сахара, забор крови из пальца – это тоже примеры капиллярных явлений.
Кровеносная система человека, начинаясь с весьма толстых сосудов, заканчивается очень разветвленной сетью тончайших капилляров. Могут вызвать интерес, например, такие данные. Площадь поперечного сечения аорты равна 8 см 2 . Диаметр же кровеносного капилляра может быть в 50 раз меньше диаметра человеческого волоса при длине 0,5 мм. В теле взрослого человека имеется порядка 160 млрд капилляров. Их общая длина доходит до 80 тыс. км.
По многочисленным капиллярам, имеющимся в почве, вода из глубинных слоев поднимается к поверхности и интенсивно испаряется. Чтобы замедлить процесс потери влаги, капилляры разрушают путем разрыхления почвы с помощью борон, культиваторов, рыхлителей.
Практическая часть
Возьмем стеклянную трубочку с очень маленьким внутренним диаметром (d < l мм), так называемый капилляр. Опустим один из концов капилляра в сосуд с водой -вода поднимется выше уровня воды в сосуде. Поверхностное натяжение способно поднимать жидкость на сравнительно большую высоту.
Поднятие жидкости вследствие действия сил поверхностного натяжения воды можно наблюдать в простом опыте. Возьмем чистую тряпочку и опустим один ее конец в стакан с водой, а другой свесим наружу через край стакана. Вода начнет подниматься по порам ткани, аналогичным капиллярным трубкам, и пропитает всю тряпочку. Избыток воды будет капать с висящего конца (см. фото 2).

Если для опыта брать ткань светлого цвета, то на фото очень плохо видно как вода распространяется по ткани. Также следует иметь в виду, что не для всякой ткани избыток воды будет капать со свисающего конца. Я этот опыт делал дважды. Первый раз использовали светлую ткань (х/б трикотаж); вода очень хорошо стекала каплями с висящего конца. Второй раз использовали темную ткань (трикотаж из смешанных волокон – х/б и синтетика); хорошо было видно как вода распространяется по ткани, но капли со свисающего конца не капали.
Поднятие жидкости по капиллярам происходит тогда, когда силы притяжения молекул жидкости друг к другу меньше сил их притяжения к молекулам твердого тела. В этом случае говорят, что жидкость смачивает твердое тело.
Если взять не очень тонкую трубочку, набрать в нее воды и пальцем закрыть нижний конец трубки, можно увидеть, что уровень воды в трубке вогнут (рис. 9).

Это результат того, что молекулы воды сильнее притягиваются к молекулам стенок сосуда, чем друг к другу.
Не все жидкости и не во всяких трубках «цепляются» за стенки. Бывает и так, что жидкость в капилляре опускается ниже уровня в широком сосуде, при этом ее поверхность - выпуклая. Про такую жидкость говорят, что она не смачивает поверхность твердого тела. Притяжение молекул жидкости друг к другу сильнее, чем к молекулам стенок сосуда. Так ведет себя, например, ртуть в стеклянном капилляре. (Рис.10)

Заключение
Итак, в ходе этой работы я убедился в том что:
- Капиллярные явления играют большую роль в природе.
- Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести действующая на столб жидкости в капилляре, не станет равной по модулю результирующей силе.
- Смачивающая жидкость в капиллярах поднимается вверх, а несмачивающая - опускается вниз.
- Высота поднятия жидкости в капилляре прямо пропорциональна поверхностному натяжению её и обратно пропорциональна радиусу канала капилляра и плотности жидкости.
Капиллярность (от лат.Capillaris - волосяной ) - физическое явление, заключающееся в способности жидкостей изменять уровень в трубках, узких каналах произвольной формы, пористых телах. Поднятие жидкости происходит в случаях смачивания каналов жидкостями, например воды в стеклянных трубках, песке, грунте и т. п. Понижение жидкости происходит в трубках и каналах, не смачиваемых жидкостью, например, ртуть в стеклянной трубке. На основе капиллярности основана жизнедеятельность животных и растений, химические технологии, бытовые явления (например, подъём керосина по фитилю в керосиновой лампе, вытирание рук полотенцем). Капиллярность почвы определяется скоростью, с которой вода поднимается в почве и зависит от размера промежутков между почвенными частицами. Капиллярами называются тонкие трубки, а также самые тонкие сосуды в организме человека и других животных.
Особенно хорошо наблюдается искривление мениска жидкости в тонких трубках, называемых капиллярами. Если в сосуд с жидкостью опустить капилляр, стенки которого смачиваются жидкостью, то жидкость поднимается по капилляру на некоторую высоту h (рис.50.1). Это объясняется тем, что искривление поверхности жидкости вызывает дополнительно молекулярное давление. Если поверхность выпуклая и имеет сферическую форму, то добавочное давление составит

Рисунок 50.1
В случае выпуклого мениска (r > 0) суммарное давление больше атмосферного и жидкость опускается по капилляру. Если мениск вогнутый (r < 0), суммарное давление меньше атмосферного и жидкость поднимается по капилляру. Жидкость поднимается (или опускается) до тех пор, пока гидростатическое давление р = ρqh столба жидкости высотой h не компенсирует добавочное (Лапласовское) давление р л. (Лаплас установил зависимость этого давления от формы мениска.) В этом случае
где ρ – плотность жидкости; g – ускорение свободного падения, r - радиус капилляра, R – радиус кривизны мениска.
Высота поднятия (глубина опускания) жидкости в капилляре:
![]() .
.
§ 51. Явление капиллярности в быту, природе и технике
Явление капиллярности в быту играет огромную роль в самых разнообразных процессах, происходящих в природе. Например, проникновение влаги из почвы в растения, в стебли и листья обусловлено капиллярностью. Клетки растения образуют капиллярные каналы, и чем меньше радиус капилляра, тем выше по нему поднимается жидкость. Процесс кровообращения тоже связан с капиллярностью. Кровеносные сосуды являются капиллярами.
Особенно большое значение имеет капиллярность почвы. По мельчайшим сосудам влага из глубины перемешивается к поверхности почвы. Если хотят уменьшить испарение влаги, то почву рыхлят, разрушая капилляры. С целью увеличения притока влаги из глубины почву укатывают, увеличивая количество капиллярных каналов. В технике капиллярные явления имеют большоезначения в процессах сушки, в строительстве.
§ 52. Давление под искривленной поверхностью жидкости
Сферическая выпуклая поверхность производит на жидкость дополнительное давление, вызванное силами внутреннего натяжения, направленными внутрь жидкости, ,R – радиус сферы. Если поверхность жидкости вогнутая, то результирующая сила поверхностного натяжения направлена из жидкости и давление внутри жидкости .
Избыточное давление внутри мыльного пузыря радиуса R вызывается действием обоих поверхностных слоев тонкой сферической мыльной пленки:
Рисунок 52.1
В общем случае избыточное давление для произвольной поверхности жидкости описывается формулой Лапласа:
![]() ,
(52.1)
,
(52.1)
где и- радиусы кривизны двух любых взаимно перпендикулярных сечений поверхности жидкости в данной точке.
Радиусы кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости.
Поверхностное натяжение сравнительно легко определяется экспериментально. Существуют различные методы определения поверхностного натяжении, которые делятся на статические, полустатичсскис и динамические. Статические методы основаны на капиллярных явлениях, связанных с искривлением поверхности раздела фаз.
С появлением кривизны поверхности между фазами меняется внутреннее давление тела и возникает дополнительное (капиллярное) давление Лапласа Р, которое может увеличивать или уменьшать внутреннее давление, характерное для ровной поверхности. Это дополнительное давление можно представить как равнодействующую сил поверхностного натяжения, направленную в центр кривизны перпендикулярно поверхности. Кривизна может быть положительной и отрицательной (рис. 2.2).
Рис. 2.2. Схема образования дополнительного давления для поверхности с положительной (а) и отрицательной (б) кривизной
Изменение объема жидкости происходит в результате самопроизвольного уменьшения поверхностной энергии и превращения ее в механическую энергию изменения объема тела. При этом в уравнении (2.2) для энергии Гельмгольца при постоянных Т, n,q
следует рассматривать только два слагаемых dF = -pdV + ods
. При равновесии dF =
0, поэтому pdV = ods
. В этом выражении р = Р
- дополнительное давление (давление Лапласа), равное разности давлений между давлением тела с плоской и изогнутой поверхностями (АР):
![]()
Отношение называется кривизной поверхности.
Для сферической поверхности . Подставляя это выражение
в уравнение для дополнительного давления, получаем уравнение Лапласа:
в котором г - радиус кривизны; - кривизна или дисперсность (рис. 2.3).
Если поверхность имеет неправильную форму, используют представление о средней кривизне и уравнение Лапласа имеет вид

где Гр /*2 - главные радиусы кривизны.

Рис. 2.3. Капиллярное поднятие жидкости при смачивании (а) и несмачивании (о) стенок капилляра
Для поверхностного натяжение уравнение Лапласа можно переписать в виде , показывающем пропорциональность поверхностного
натяжения радиусу капилляра г и давлению Р, при котором происходит проскок газового пузырька из капилляра, опущенного в жидкость. Именно на этой пропорциональности основан метод экспериментального определения поверхностного натяжения Ребиндера.
В методе Ребиндера измеряется давление, при котором происходит проскок газового пузырька из капилляра, опущенного жидкость. В момент проскакивания пузырька измеряемое давление будет равно капиллярному, в радиус кривизны поверхности - радиусу капилляра. В опыте радиус капилляра измерить практически невозможно, поэтому проводят относительные измерения: определяют давление в газовом пузырьке, проскакивающем через жидкость с известным поверхностным натяжением (эту жидкость называют стандартной), а затем - давление Р в газовом пузырьке, проскакивающем через жидкость с определяемым поверхностным натяжением. В качестве стандартной жидкости обычно используется дистиллированная вода, а для точных измерений - бидистиллят.
Отношение поверхностного натяжения стандартной жидкости к давлению в пузырьке, который через нее проскакивает, называют константой
капилляра . При известной величине поверхностного натяжения
(т 0 и измеренных давлениях и Р для стандартной и исследуемой жидкости поверхностное натяжение последней определяется основной расчетной формулой данного метода:
Если значение известно с высокой точностью, то величина поверхностного натяжения определяемой жидкости тоже будет точной. Метод Ребиндера дает точность определения поверхностного натяжения до 0,01 мДж/м 2 .
При использовании метода поднятия измеряют высоту поднятия (или опускания) жидкости в капилляре и сравнивают сс с высотой поднятия стандартной жидкости, у которой поверхностное натяжение известно (рис. 2.4).

Рис. 2.4.
Причина капиллярного поднятия заключается в том, что жидкость, смачивая стенки капилляра, образует определенную кривизну поверхности, а возникающее при этом капиллярное давление Лапласа поднимает жидкость в капилляре до тех пор, пока вес столба жидкости не уравновесит действующую силу. Поднятие жидкости в капилляре наблюдается тогда, когда кривизна поверхности жидкости отрицательна. При вогнутом мениске давление Лапласа стремится растянуть жидкость и поднимает ее, такое капиллярное поднятие называется положительным, оно характерно для жидкостей, которые смачивают стенки капилляра (например, в системе стекло - вода). Наоборот, если кривизна поверхности положительна (выпуклый мениск), то дополнительное давление стремится сжать жидкость и наблюдается ее опускание в капилляре, которое называют отрицательным капиллярным подъемом. Подобное явление характерно для случаев несмачивания жидкостью стенок капилляра (например, в системе стекло - ртуть).
Судя но рис. 2.4. смачивание влияет на геометрию поверхности и если г - радиус кривизны, то радиус самого капилляра R связан с ним соотношением
![]()
где в - краевой угол смачивания (острый при условии смачивания жидкостью стенок капилляра). Из последнего соотношения следует, что
Подставляя это соотношение в уравнение (2.4), получаем

Если учесть, что давление столба жидкости в уравнении pdV = ods
связано с его высотой как mgh = V(p-p^)gh,
можно получить соотношение
 и далее формулу Жюрена:
и далее формулу Жюрена:

где h - высота поднятия жидкости в капилляре; р - плотность жидкости; p s - плотность ее насыщенного пара; g - ускорение свободного падения.
При условии, что плотность жидкости р и плотность ее насыщенного пара p s несопоставимы (р »p s) для поверхностного натяжения можно записать

В более упрощенной формуле предполагается еще и полное смачивание стенок сосуда жидкостью (cos в = 1):
^ _ 2(7
gR(p-Ps)"
При практическом использовании метода вычисление поверхностного натяжения производят по формуле

где и h - высота поднятия в капилляре стандартной и исследуемой жидкостей; р^и р - их плотности.
Использовать этот метод как точный можно при условии cos в - const , лучше в = 0°, что для многих жидкостей приемлемо без дополнительных условий. В эксперименте необходимо использовать тонкие капилляры, хорошо смачиваемые жидкостью. Метод капиллярного поднятия также может дать высокую точность определения поверхностного натяжения, до 0,01-0,1 мДж/м